Периодический закон Менделеева является фундаментальным принципом химии. Впервые сформулированный Дмитрием Ивановичем Менделеевым в 1869 году, этот закон объясняет основные свойства химических элементов и располагает их в определенном порядке в таблице, известной как периодическая система.
Основная идея закона заключается в том, что свойства элементов имеют периодическую зависимость от их атомных номеров. Атомный номер определяет количество протонов в атоме, а также определяет положение элемента в периодической таблице.
Периодический закон Менделеева позволяет установить связи между различными элементами и предсказать их химическое и физическое поведение. Он позволяет наглядно организовать информацию о химических элементах и отражает закономерности их свойств.
Этот закон имеет огромное значение для химии и других наук, так как позволяет классифицировать элементы, прогнозировать их свойства и даже открывать новые элементы. Он служит основой для исследований в области химии элементов и их соединений и является незаменимым инструментом для химиков и исследователей.
История открытия периодического закона
Первые шаги на пути открытия периодического закона были сделаны Джоном Далтоном в начале XIX века. Он разработал теорию атомов и формулы соединений, что стало основой для дальнейших исследований.
В 1817 году Йозефом Берцелиусом была разработана систематическая номенклатура для элементов, что позволило систематизировать сведения о химических элементах и создать фундамент для будущих открытий.
Одним из важнейших этапов на пути к открытию периодического закона стало открытие лантаноидов и активных металлов в середине XIX века. Ученые Сериямой Тёдоревичем Гадолином, Карлом Стремли и Карлом Густавом Мосандером внесли значимый вклад в исследование химических элементов.
Однако настоящим прорывом стало открытие Менделеевым периодического закона в 1869 году. Менделеев провел комплексный анализ свойств и составов известных элементов и предложил их систематическую организацию. В результате он смог вывести периодическую закономерность, которая стала основой для современной таблицы химических элементов.
Открытие Менделеева имело огромные последствия для развития химии. Оно позволило предсказывать свойства неизвестных элементов и заполнять пробелы в таблице. Это стало отправной точкой для новых открытий и дальнейшего развития науки.
В конце XIX — начале XX века было открыто множество новых элементов, подтверждающих правильность периодического закона. Исследования Менделеева и дальнейшие открытия ученых привели к построению современной таблицы химических элементов, которую мы используем до сих пор.
История открытия периодического закона свидетельствует о замечательных открытиях и достижениях ученых, которые проложили путь к пониманию и систематизации мира химических элементов.
Работы Димитрия Менделеева
Работы Менделеева включают в себя:
- Периодическая система химических элементов – это его самое известное достижение. В 1869 году Менделеев опубликовал таблицу, в которой он упорядочил элементы по их атомным массам и свойствам. Эта система стала фундаментом современной химии и позволила предсказывать свойства еще неизвестных элементов.
- Уравнение Менделеева-Клапейрона – Менделеев предложил уравнение, которое описывает физическое идеального газа. Это уравнение широко используется в химии и физике.
- Работы над веществами органической природы – Менделеев провел много экспериментов с органическими веществами и разработал методы их анализа и классификации.
- Книга «Принципы химии» – в этой книге Менделеев систематизировал знания о химии и представил свои теории и идеи.
Работы Димитрия Менделеева имеют важное значение и до сих пор используются в образовании и научных исследованиях.
Открытие промежуточных элементов
В процессе развития химии было открыто множество новых элементов, не предвиденных первоначальной классификацией Менделеева. Такие элементы, находящиеся между существующими в таблице периодических элементов, называются промежуточными.
Первым промежуточным элементом, открытым после создания классической таблицы Менделеева, стал германий. Этот элемент был открыт в 1886 году немецким химиком Клеменсом Александром Винклером. Германий находится между кремнием и оловом и обладает химическими свойствами, характерными для металлов и неметаллов.
Следующим промежуточным элементом, открытым в 1898 году, стал скандий. Этот элемент был открыт шведским химиком Ларсом Фредриком Нильсоном и датским химиком Андреем Густавом Эккартом. Скандий находится между кальцием и титаном и обладает хорошей пластичностью и коррозионной стойкостью.
Затем были открыты такие промежуточные элементы, как галлий, германий, алюминий, полоний и другие. Постепенно таблица периодических элементов была дополнена новыми открытиями, что позволило лучше понять химические свойства и закономерности взаимодействия различных элементов.
Открытие промежуточных элементов позволило более полно описать и систематизировать свойства элементов и сделало классическую формулировку периодического закона Менделеева еще более точной и универсальной.
Принципы периодического закона
Существует несколько принципов, на которых основан периодический закон:
1. Принцип возрастания атомного номера — элементы в периоде или группе располагаются в порядке возрастания атомных номеров. Атомный номер является характеристикой элемента, определяющей его положение в периодической системе.
2. Принцип возрастания атомного радиуса — при движении по периоду атомный радиус элементов обычно уменьшается. Это объясняется увеличением заряда ядра и притяжением электронов к ядру.
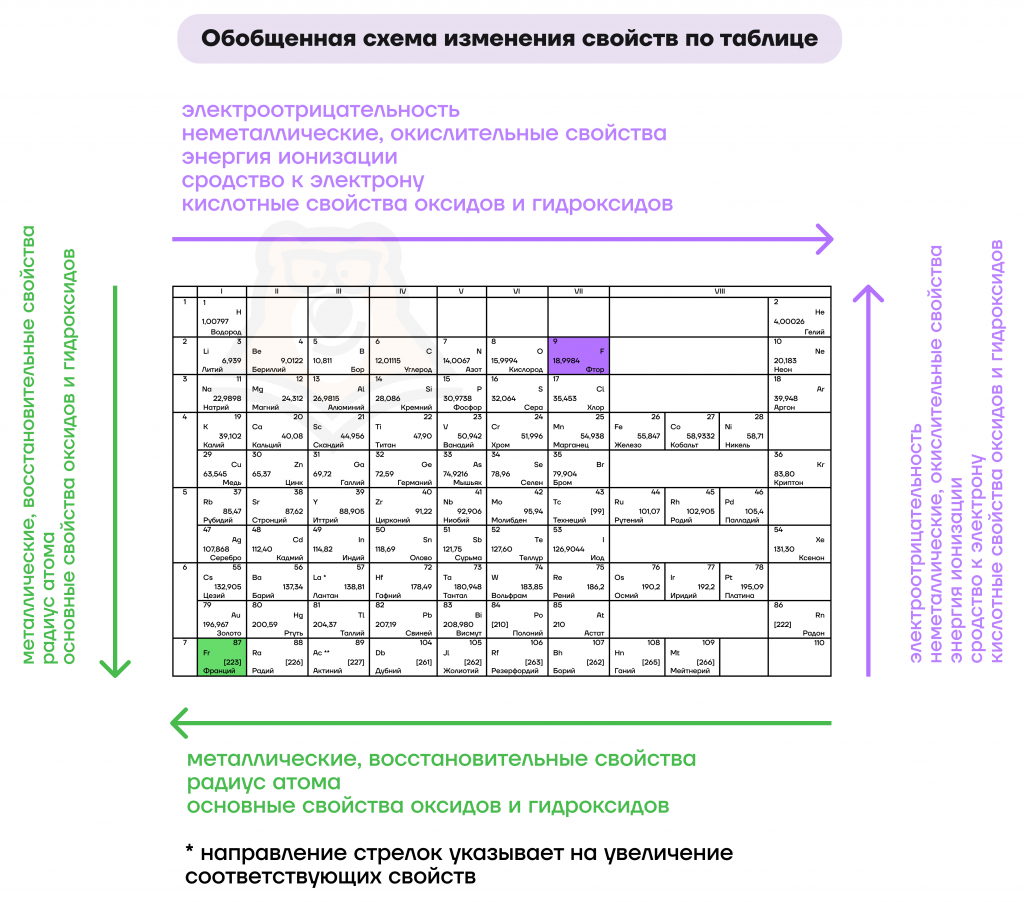
3. Принцип возрастания электроотрицательности — электроотрицательность элементов в периоде обычно увеличивается с возрастанием атомного номера. Электроотрицательность определяет способность атома притягивать электроны к себе в химических связях.
4. Принцип возрастания ионизационной энергии — ионизационная энергия элементов обычно увеличивается с возрастанием атомного номера в периоде. Ионизационная энергия — это энергия, необходимая для удаления электрона из атома.
5. Принцип периодичности химических свойств — элементы в одной колонке (группе) обладают сходными химическими свойствами. Это связано с одинаковым количеством электронов во внешней оболочке атома, определяющих его химическую активность.
Соблюдение данных принципов позволяет упорядочить элементы в периодической системе и предсказывать их свойства на основе их положения в системе.
Законичность изменения свойств элементов
Периодический закон Менделеева представляет собой систематическое расположение химических элементов в порядке возрастания их атомных номеров. Этот закон существенно упрощает изучение и понимание свойств химических элементов.
Одной из основных особенностей периодического закона является его закономерная изменчивость свойств элементов в пределах периодов и групп. При движении по периодам элементы отличаются по своим химическим и физическим свойствам.
В периодической системе Менделеева вертикальные строки называются группами, а горизонтальные строки — периодами. Группы содержат элементы с схожими свойствами, в то время как элементы в пределах одной группы отличаются по своим размерам и массам.
Так, к примеру, первая группа периодической системы состоит из щелочных металлов, которые обладают высокой реактивностью и образуют сильные основания. Вторая группа состоит из щелочноземельных металлов, которые тоже обладают реактивностью, но не такой высокой, как в первой группе.
Таким образом, периодический закон Менделеева позволяет обнаружить и анализировать закономерные изменения в свойствах элементов в зависимости от их положения в периодической системе. Это делает его ценным инструментом для химиков и исследователей, помогая им понять и предсказывать химическое поведение элементов.
Классификация элементов по атомным массам
Периодический закон Менделеева позволяет классифицировать элементы по атомным массам. В основе этой классификации лежит закономерность изменения атомных масс элементов в периоде и группе.
Период в таблице Менделеева представляет собой горизонтальный ряд, который содержит элементы с похожими свойствами. Периоды нумеруются от 1 до 7. Каждый период начинается с атома с наименьшей атомной массой и заканчивается элементом с наибольшей атомной массой. По мере продвижения отлево направо в периоде, атомные массы элементов обычно увеличиваются.
Группа в таблице Менделеева представляет собой вертикальную колонку, которая объединяет элементы с аналогичными химическими свойствами. Группы нумеруются от 1 до 18. Внутри каждой группы, атомные массы элементов могут значительно различаться.
Таким образом, классификация элементов по атомным массам помогает установить закономерности в свойствах химических элементов. Эта классификация является важной основой для построения периодической системы элементов и понимания их химической природы.
Предсказание свойств новых элементов
Менделеев предсказал свойства нескольких элементов, которые были открыты позже. Например, он предсказал существование и свойства таких элементов, как галлий, германий и скандий. Впоследствии эти элементы были действительно открыты и их свойства соответствовали предсказаниям Менделеева.
Современные ученые продолжают использовать периодический закон Менделеева для предсказания свойств новых элементов. С помощью закономерностей периодической системы они могут сделать предположения о химических и физических свойствах элементов, которые еще не были открыты.
Предсказание свойств новых элементов является важным этапом в исследовании химической природы веществ. Это позволяет ученым понять, какие свойства могут иметь элементы, которых пока еще нет в таблице Менделеева, и как эти элементы могут взаимодействовать с другими веществами. Такие предсказания помогают дальнейшему развитию науки и находке новых веществ с уникальными свойствами.
Расположение элементов в таблице Менделеева
Таблица Менделеева состоит из строк, называемых периодами, и столбцов, называемых группами. Периоды обозначаются числами от 1 до 7, а группы обозначаются латинскими буквами от A до H. Каждая ячейка таблицы представляет собой отдельный химический элемент.
Группы в таблице Менделеева объединяют элементы с аналогичными химическими свойствами. Например, элементы группы В – это металлы, а элементы группы А – неметаллы. Кроме того, элементы каждой группы имеют одинаковое количество внешних электронов в своих атомах.
Периоды в таблице Менделеева показывают изменение электронной конфигурации атомов элементов. В каждом следующем периоде количество электронных оболочек увеличивается на одну. Также внутри каждого периода происходят изменения внутренней структуры атомов.
Такое расположение элементов в таблице Менделеева позволяет с легкостью находить закономерности, связанные с химическими свойствами элементов и их атомной структурой. Это помогает химикам определять свойства новых элементов и предсказывать их реакционную способность и соединительную способность.
Таблица Менделеева – это основа периодического закона, который позволяет систематизировать и классифицировать все химические элементы. Благодаря ей мы можем лучше понимать и изучать мир вокруг нас в его химическом аспекте.
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Период | 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||||||||||
| 1 | H | He | Li | Be | B | C | N | O | F | Ne | Na | Mg | Al | Si | P | S | Cl | Ar |
| 2 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 3 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 4 | Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 5 | Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
Группы и периоды элементов
Периодическая система химических элементов состоит из 18 вертикальных столбцов, называемых группами, и 7 горизонтальных строк, называемых периодами. Группы элементов объединены похожими свойствами, а периоды представляют собой последовательность увеличения атомного номера элементов.
Всего в первом периоде расположен 2 элемента: водород (H) и гелий (He). Второй период содержит 8 элементов: литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F) и неон (Ne).
Группы элементов в периодической системе обозначаются цифрами от 1 до 18. Группы 1 и 2 называются скалирующими металлами, так как они обладают особенностями, характерными для металлов. В группе 1 находятся щелочные металлы (лиитий, натрий, калий и др.), а в группе 2 — щелочноземельные металлы (магний, кальций, барий и др.).
Группа 17 (побочные группы) называется галогенами (фтор, хлор, бром и др.), а группа 18 является инертными газами (гелий, неон, аргон и др.), которые практически не образуют химических соединений.
В остальные группы входят переходные и благородные металлы, а также элементы других химических групп. Каждая группа обладает уникальными свойствами, которые определяются структурой электронных оболочек атомов элементов.
По мере увеличения атомного номера, элементы в периоде изменяют свои свойства. Например, в первом периоде находятся самые легкие элементы, обладающие газообразным или металлическим состоянием. Во втором периоде элементы уже образуют соединения с другими элементами и имеют различные химические свойства.
Понимание групп и периодов элементов помогает установить систематику их свойств, что помогает в изучении химии и предсказании химических реакций.
Вопрос-ответ:
Какова классическая формулировка периодического закона Менделеева?
Классическая формулировка периодического закона Менделеева гласит, что свойства элементов повторяются периодически при их упорядочении по возрастанию атомных масс.
Какие свойства элементов повторяются по периодам?
По периодам повторяются электронная конфигурация элементов, атомный радиус, ионный радиус, электроотрицательность, энергия ионизации и атомный объем.
Что значит упорядочение элементов по возрастанию атомных масс?
Упорядочение элементов по возрастанию атомных масс означает, что элементы располагаются в таблице Менделеева в порядке увеличения массы их атомов от легких к тяжелым.
Кто предложил классическую формулировку периодического закона Менделеева?
Классическая формулировка периодического закона Менделеева была предложена самим Дмитрием Ивановичем Менделеевым, российским химиком и ученым.
Какой была основная идея, лежащая в основе периодического закона Менделеева?
Основная идея периодического закона Менделеева заключается в том, что элементы схожих свойств должны иметь схожие атомные массы и поэтому следует упорядочивать элементы в таблице Менделеева по возрастанию атомных масс.