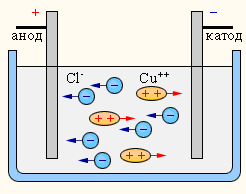
Электролиз – это процесс разложения химического соединения с помощью электрического тока. Впервые электролиз был открыт исследователем Майклом Фарадеем в начале XIX века. Он доказал, что электролиз сопровождается переносом заряда и обратимостью реакций.
Основными законами электролиза являются закон Фарадея и закон Кулона. Закон Фарадея, или второй закон электролиза, утверждает, что вещество, выделяемое или осаждаемое на электроде, пропорционально количеству электричества, прошедшего через электролит. То есть, чем больше заряд, прошедший через раствор, тем больше вещества будет выделено на электроде.
Закон Кулона, или первый закон электролиза, утверждает, что масса выделенного вещества пропорциональна количеству заряда и обратно пропорциональна эквивалентной массе вещества. Эквивалентная масса – это масса вещества, выделяющегося или осаждаемого на электроде при прохождении одного кулона электричества.
Принципы электролиза активно применяются в различных областях, включая электрохимию, гальванические элементы и производство металлов. Например, электролиз используется для получения чистых металлов из их соединений, для оцинковки и хромирования металлических изделий, а также для удаления окислов и примесей из металлов.
Основные принципы законов электролиза
Первый закон электролиза, или закон Фарадея, устанавливает прямую пропорциональность между количеством вещества, отложившегося на электродах, и электрическим зарядом, протекающим через электролит. То есть, количество вещества, полученного или растворенного в результате электролиза, пропорционально количеству электричества, протекшего через систему. Это соотношение можно выразить следующей формулой:
m = q * M / (n * F),
где m — количество вещества (в молях), q — заряд (в кулонах), M — молярная масса вещества (в г/моль), n — количество электронов, участвующих в реакции, F — постоянная Фарадея (96485 Кл/моль).
Второй закон электролиза гласит, что масса вещества, отложившегося на электродах, пропорциональна амперажу и времени, в течение которого протекает электролиз. Формула для вычисления массы вещества, отложившегося на электроде, выглядит следующим образом:
m = I * t * z / M,
где I — сила тока (в амперах), t — время электролиза (в секундах), z — число электронов, участвующих в реакции для одной молекулы вещества, M — молярная масса вещества (в г/моль).
Третий закон электролиза, или закон Грея-Люндгвиста, утверждает, что скорость электролиза пропорциональна концентрации электролита в растворе. Иными словами, чем выше концентрация электролита, тем быстрее протекает электролиз. Этот закон описывается следующей формулой:
I = k * c * A,
где I — интенсивность тока (в амперах), k — постоянная пропорциональности, зависящая от природы электролита и условий электролиза, c — концентрация электролита (в моль/л), A — площадь электродов (в квадратных метрах).
Законы электролиза являются базовыми принципами, лежащими в основе множества промышленных и научных процессов, таких как получение металлов, электрохимический синтез органических соединений и другие.
Закон Фарадея: связь массы вещества с электрическим зарядом
Суть закона Фарадея состоит в том, что каждая взаимно-электродная реакция имеет свой определенный заряд, необходимый для протекания этой реакции. При этом масса осажденного вещества прямо пропорциональна количеству электричества, прошедшего через раствор.
Количество электричества определяется формулой:
Q = I * t
где Q – количество электричества (заряд) в кулонах, I – сила тока, проходящего через раствор в амперах, t – время в секундах.
Таким образом, чем больше заряд прошел через раствор, тем больше вещества будет осаждено на электродах. Закон Фарадея применим к электролизу водных растворов и плавящихся солей.
Например, если через раствор прошел заряд равный 2 кулонам, исходя из закона Фарадея, на электроде будет осаждено вещество массой пропорционально 2 г.
Определение закона Фарадея
Закон Фарадея, известный также как закон электролиза, был сформулирован Майклом Фарадеем в XIX веке. Согласно этому закону, масса вещества, выделившегося или растворившегося при электролизе, пропорциональна количеству электричества, протекшего через электролит.
Закон Фарадея можно представить в виде математической формулы:
| Масса вещества (м) | = | Молекулярная масса (М) * Количество заряда (Q) | (1) |
где масса вещества измеряется в граммах, молекулярная масса — в г/моль, количество заряда — в кулонах.
Закон Фарадея позволяет предсказать и объяснить результаты электролиза для различных веществ. Он имеет важное практическое значение как в химическом анализе, так и в промышленном производстве.
Примеры применения закона Фарадея
1. Электрохимическая обработка металлов: Закон Фарадея используется в процессах электрохимической обработки металлов, таких как гальванизация и анодирование. Это позволяет нанести защитное покрытие на металлические изделия, улучшить их внешний вид и защитить от коррозии.
2. Электролиз воды: Одним из примеров применения закона Фарадея является расщепление воды на кислород и водород с использованием электрического тока. Этот процесс называется электролизом воды и может использоваться для производства водорода, который является экологически чистым источником энергии.
3. Электрохимические сенсоры: Закон Фарадея применяется в электрохимических сенсорах, которые используются для измерения концентрации различных веществ. Например, электрохимический датчик pH использует изменение потенциала, вызванное реакцией водорода на планарном электроде, для определения уровня кислотности или щелочности раствора.
4. Электрохимические аккумуляторы: Закон Фарадея применяется в электрохимических аккумуляторах, таких как свинцово-кислотные и литий-ионные аккумуляторы. При зарядке и разрядке этих аккумуляторов происходят электрохимические реакции, в результате которых происходит накопление и освобождение электрической энергии.
5. Электролитическое получение металлов: Закон Фарадея применяется в процессе электролитического получения металлов, таких как алюминий, медь, цинк и др. В этом процессе металлы извлекаются из их соединений с помощью электролиза.
Все эти примеры демонстрируют практическое применение закона Фарадея в различных областях науки и техники. Электролиз является важным процессом, позволяющим получать и использовать различные вещества с помощью электричества.
Закон Авогадро: соотношение объемов газов и их мольных количеств
Закон Авогадро устанавливает важное соотношение между объемами газов и их мольными количествами. Он был открыт и исследован итальянским ученым Амедео Авогадро в 1811 году.
Суть закона состоит в том, что при одинаковых условиях температуры и давления объемы различных газов, содержащих одинаковое количество молекул (то есть одинаковое количество вещества), будут одинаковыми. Таким образом, мольный объем газа является постоянной величиной независимо от его состава или свойств.
Математическая формулировка закона:
«При одинаковых условиях температуры и давления объемы различных газов, содержащих равное количество молекул (равное количество вещества), равны между собой.»
Закон Авогадро был одним из основополагающих принципов развития атомистической теории в химии и позволил установить соотношение между массой вещества и количеством вещества. Этот закон имеет практическое значение при решении ряда задач по расчету объемов газов в химических реакциях и применяется во многих областях науки и техники.
Определение закона Авогадро
Таким образом, количество вещества, измеряемое в молекулах, атомах или ионах, пропорционально его объему. Закон Авогадро является важным для понимания структуры и свойств газов и является фундаментальным принципом в химических расчетах и уравнениях реакций.
Константа Авогадро, обозначаемая как NA, равна числу атомов углерода-12 в 12 граммах этого элемента. Ее значение составляет около 6,02214 x 1023. Это число называется также число Авогадро и используется для перехода от макроскопических величин, таких как масса и объем, к микроскопическим величинам, связанным с частицами вещества.
Примеры применения закона Авогадро
Принцип Авогадро имеет широкое применение в различных областях химии и науки в целом. Рассмотрим несколько примеров его использования:
1. Определение молекулярной массы соединений:
С помощью закона Авогадро можно определить молекулярную массу соединений. Исходя из известного количества вещества, можно определить массу и количество молекул в данном объеме газа. Зная массу газа и количество молекул, можно найти массу одной молекулы и, таким образом, молекулярную массу соединения.
2. Вычисление коэффициентов в реакциях:
3. Расчет теоретической выходности в реакциях:
Закон Авогадро позволяет рассчитать теоретическую выходность продуктов в химических реакциях. Опираясь на объемы реагентов и их коэффициенты, можно определить количество молекул каждого реагента и количества молекул продуктов. Это позволяет предсказать, какие продукты образуются и в каких количествах в результате реакции.
Таким образом, закон Авогадро играет важную роль в химических расчетах и позволяет получать информацию о количестве вещества, коэффициентах реакций и молекулярных массах соединений. Его применение широко распространено в области аналитической и физической химии, а также в практических приложениях, связанных с химическими реакциями и газовыми законами.
Закон Гей-Люссака: соотношение объемов и коэффициентов стехиометрического уравнения
Закон Гей-Люссака, также известный как закон атомных объемов, устанавливает соотношение между объемами реагирующих газов и их коэффициентами в стехиометрическом уравнении. Согласно этому закону, объемы реагентов и продуктов в газообразной реакции стоят в простом числовом соотношении и при одинаковых условиях (температура и давление), составляются из одинакового числа молекул.
Например, предположим, что имеется следующая газообразная реакция:
2H₂(g) + O₂(g) → 2H₂O(g)
В этом уравнении коэффициенты перед газами указывают на количество молекул, участвующих в реакции. Закон Гей-Люссака говорит нам, что отношение объемов реагирующих газов и их коэффициентов также будет равно. Таким образом, если объем первого газа равен V₁, а второго — V₂, то отношение этих объемов будет следующим:
| Газ | Коэффициент | Объем (V) |
|---|---|---|
| H₂ | 2 | V₁ |
| O₂ | 1 | V₂ |
| H₂O | 2 | V₃ |
То есть, V₁:V₂:V₃ = 2:1:2.
Этот закон можно использовать для определения объемов газов в реакции, если известны объемы их реагентов или продуктов, а также их коэффициенты в уравнении.
Важно отметить, что закон Гей-Люссака справедлив только для газовых реакций и при соблюдении условий постоянства температуры и давления.
Определение закона Гей-Люссака
Согласно закону Гей-Люссака, при реакции газовых веществ объемы этих газов и их коэффициенты в уравнении реакции всегда находятся в простой численной пропорции друг к другу при постоянных физических условиях.
Например, если в уравнении реакции газу А соответствует коэффициент 2, то газу В соответствует коэффициент 3, а газу С – коэффициент 4. Таким образом, объемы газов будут иметь пропорцию 2:3:4.
Закон Гей-Люссака является важным инструментом для изучения реакций газов в химических процессах и позволяет предсказывать соотношение объемов газовых компонентов в реакции и их влияние на ход процесса.
Вопрос-ответ:
Что такое электролиз?
Электролиз — это химическое разложение вещества с помощью электрического тока.
Какие законы регулируют процесс электролиза?
Основные законы, регулирующие процесс электролиза, включают закон Фарадея и закон Кулона.
Что гласит закон Фарадея?
Закон Фарадея утверждает, что количество вещества, осажденного или растворенного в результате электролиза, пропорционально количеству электричества, прошедшего через электролит.
Какое влияние оказывает масса ионов на скорость реакции при электролизе?
Масса ионов оказывает прямое влияние на скорость реакции: чем больше масса иона, тем медленнее протекает реакция.
Какие примеры можно привести в контексте законов электролиза?
Примеры электролиза включают разложение воды на водород и кислород, покрытие металлических изделий никелем или хромом, и т.д.
Что такое электролиз?
Электролиз – это процесс, при котором разложение химического вещества происходит под действием электрического тока.