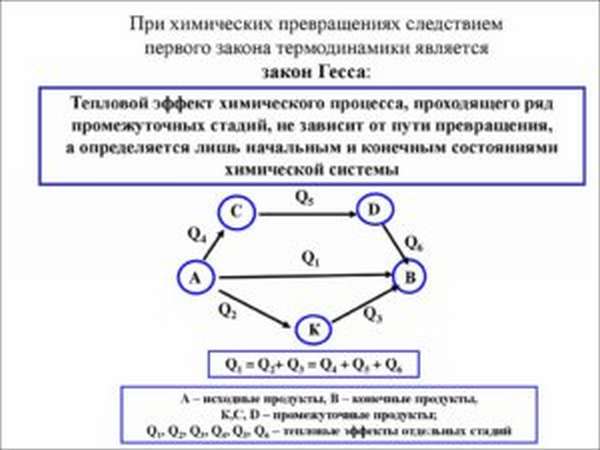
Закон Гесса — это фундаментальный принцип, который помогает понять и объяснить химические реакции и изменение энергии, происходящие в химических системах. Сформулированный Германом Гессом в 1840 году, закон Гесса показал, что изменение энергии в химической реакции не зависит от пути, по которому происходит реакция.
Следствия закона Гесса имеют важное значение для химической термодинамики и позволяют упростить расчеты энергетических процессов. Закон позволяет предсказывать термодинамические свойства реакций, которые не являются прямыми, а происходят через ряд последовательных или параллельных реакций. Это делает закон Гесса мощным инструментом для изучения и понимания реакций на молекулярном уровне.
Влияние закона Гесса на физические и химические процессы
Этот закон имеет влияние на физические и химические процессы следующим образом:
- Прогнозирование теплового эффекта реакции. Закон Гесса позволяет предсказать изменение энтальпии химической реакции, исходя из известных значений тепловых эффектов других реакций. Это особенно полезно, когда прямое измерение энтальпии реакции трудно или невозможно.
- Объяснение энергетического баланса. Закон Гесса помогает объяснить, почему некоторые реакции происходят с выделением тепла (экзотермические), а другие — с поглощением (эндотермические). Он позволяет установить связи между энтальпийными изменениями различных реакций и процессов.
- Определение теплоемкости. Закон Гесса является основой для определения теплоемкости системы, то есть количества теплоты, которое нужно или можно получить или отдать для изменения температуры системы на определенное значение. Это важно для понимания поведения веществ при нагревании или охлаждении.
- Расчет стандартных энтальпий образования. Стандартная энтальпия образования — это энтальпийное изменение, которое происходит при образовании одного моля вещества из элементов в своих стандартных состояниях. Закон Гесса позволяет расчитать стандартные энтальпии образований различных веществ на основе известных тепловых эффектов.
Формулировка закона Гесса
С другими словами, сумма изменений энтальпии всех промежуточных реакций между начальным и конечным состояниями реакции равна изменению энтальпии для полной реакции, которая прямо связана с начальными и конечными состояниями реагентов и продуктов реакции.
Физические процессы, регулируемые законом Гесса
Следствие закона Гесса применимо к ряду физических процессов, которые можно регулировать с помощью этого закона. В основе этого следствия лежит принцип сохранения энергии.
Одним из примеров является газовая химическая реакция. Закон Гесса позволяет определить изменение энтальпии реакции, регулируя физические условия, такие как давление и температура.
Другим примером является смешение растворов. При смешении растворов происходят физические процессы, в результате которых изменяются температура и объем системы. С помощью закона Гесса можно вычислить энтальпию смешения растворов и регулировать физические параметры для получения желаемого результата.
Теплоемкость твердого тела — еще один физический процесс, регулируемый законом Гесса. Закон Гесса позволяет вычислить изменение теплоемкости твердого тела при изменении его состояния или параметров.
Таким образом, закон Гесса позволяет регулировать и предсказывать физические процессы, определяя их энтальпию или теплоемкость. Это открывает широкие возможности для контроля и оптимизации различных процессов в химии, физике и других науках.
Химические реакции, подчиняющиеся закону Гесса
Многие химические реакции подчиняются закону Гесса. Например, можно рассмотреть горение углеводородов, таких как метан. Вначале метан реагирует с кислородом, образуя углекислый газ (CO2) и воду (H2O) с высокой энтальпией. Затем этот CO2 и H2O реагируют снова с кислородом, образуя CO2 и H2O с низкой энтальпией. Окончательное изменение энтальпии реакции будет одинаковым, независимо от пути реакции.
Также под принципы закона Гесса попадают растворения солей. Например, рассмотрим растворение кристаллов кальция в воде. Этот процесс может происходить сразу или через несколько промежуточных шагов. Однако, независимо от пути реакции, полное изменение энтальпии будет таким же, как если бы процесс произошел в одном шаге.
Закон Гесса применяется также в решении задач по химическим расчетам и предсказанию результатов химических реакций. Используя принципы закона Гесса, можно предсказать изменение энтальпии для сложных реакций, зная изменение энтальпии для более простых реакций.
Причины соблюдения закона Гесса
Первая причина состоит в том, что закон Гесса обеспечивает сохранение энергии во время химических реакций. Закон Гесса утверждает, что изменение энтальпии химической реакции не зависит от пути ее протекания и определяется только исходными и конечными состояниями системы. Это означает, что температурная зависимость реакций может быть учтена и прогнозирована с использованием данного закона.
Вторая причина связана с упрощением изучения химических реакций. Закон Гесса позволяет связать различные реакции между собой и предсказать их энергетические характеристики на основе данных о начальных и конечных позициях соответствующих веществ. Это делает изучение сложных химических процессов более удобным и позволяет легче понять основные принципы, определяющие их изменения.
Третья причина заключается в возможности оптимизации химических реакций. Используя данные о тепловых эффектах различных реакций, в соответствии с законом Гесса можно производить расчеты, позволяющие выбирать оптимальные условия для достижения требуемого результата. Это способствует более эффективному использованию реагентов и ресурсов и повышению экономической эффективности химических процессов.
Четвертая причина заключается в широком применении закона Гесса. Этот принцип применим не только во время реакций в растворах, но и во многих других областях химии, таких как физическая химия, биохимия, органическая химия и даже инженерная химия. При соблюдении закона Гесса можно достичь более точных и надежных результатов в этих областях.
Энергия активации и переходные состояния
Переходные состояния — это временные состояния, которые образуются в процессе реакции и представляют собой промежуточные стадии между реагентами и продуктами. Эти состояния имеют высокую энергию, так как находятся на пути образования новых химических связей или разрыва старых связей.
Энергия активации и переходные состояния играют важную роль в химических реакциях, поскольку определяют скорость реакции. Чем выше энергия активации, тем медленнее проходит реакция, так как вероятность достижения переходного состояния снижается. Однако, если энергия активации низкая, реакция может проходить быстро и эффективно.
Энергия активации и переходные состояния могут быть изменены различными факторами, такими как температура, концентрация реагентов и наличие катализаторов. Высокая температура обычно увеличивает энергию активации, что приводит к увеличению скорости реакции. Катализаторы также снижают энергию активации, ускоряя реакцию без изменения конечных продуктов.
Устранение энтропийного фактора
При применении закона Гесса в химических реакциях, необходимо учитывать энтропийные изменения, которые могут вносить существенное влияние на итоговую энергию реакции.
Внутренняя энергия реакций может изменяться в зависимости от изменения энтропии, которая представляет собой меру хаоса или беспорядка системы. Закон Гесса утверждает, что внутренняя энергия реагентов и продуктов может быть равна, независимо от пути реакции. Однако энтропия системы может изменяться в ходе реакции.
Чтобы учесть возможное изменение энтропии, необходимо определить, какие элементы или соединения представляют собой основные источники энтропии в системе и как они могут быть учтены в расчетах.
В случаях, когда энтропийный фактор играет существенную роль, можно применить различные стратегии для его устранения:
- Исключение энтропийных компонентов: При расчете энергии реакции можно проигнорировать основные источники энтропии и сосредоточиться на изменениях энергии, связанных только с химическими реагентами и продуктами.
- Учет энтропии при выборе реагентов: При выборе реагентов можно учитывать их энтропию и стремиться использовать соединения с низкой энтропией, чтобы минимизировать изменение энтропии системы в ходе реакции.
- Использование физических методов: Некоторые физические методы, такие как охлаждение или замораживание, могут помочь уменьшить энтропию системы и тем самым устранить энтропийный фактор.
Важно помнить, что устранение энтропийного фактора может быть сложной задачей, требующей дополнительных расчетов и экспериментов. Однако это необходимо для более точного предсказания энергии реакции и понимания ее механизма.
Значение закона Гесса в определении тепловых эффектов реакций
Значение закона Гесса заключается в возможности использования тепловых эффектов реакций, известных по результатам измерений или табличным данным, для определения теплового эффекта других реакций. Это особенно полезно, если напрямую измерить тепловые эффекты некоторых реакций невозможно, либо затруднительно.
Согласно закону Гесса, тепловой эффект реакции равен разности тепловых эффектов прямых и обратных реакций, проходящих по одним и тем же начальным и конечным состояниям. Это облегчает определение тепловых эффектов сложных и многоступенчатых реакций путем суммирования тепловых эффектов более простых реакций.
Также закон Гесса позволяет предсказывать тепловой эффект реакций, проведение которых невозможно или нежелательно. Зная тепловые эффекты промежуточных реакций, можно предсказать тепловой эффект итоговой реакции.
Тепловые эффекты реакций имеют важное значение для химической промышленности и научных исследований. Закон Гесса облегчает изучение и практическое применение тепловых эффектов реакций, позволяя определить их даже в тех случаях, когда прямое измерение этих величин затруднительно.
Вопрос-ответ:
Какое значение имеет закон Гесса в химии?
Закон Гесса является основополагающим принципом в химии, который утверждает, что изменение энергии реакции зависит только от состояния начальных и конечных веществ, а не от пути, по которому происходит реакция. Это позволяет нам определить энергетическую эффективность различных химических реакций и прогнозировать их результаты.
Каким образом закон Гесса помогает в изучении химических реакций?
Закон Гесса позволяет нам расчетно определить энергетическую эффективность химических реакций. Мы можем использовать известные тепловые константы для реакций, чтобы определить изменение энергии реакции и, следовательно, ее термодинамическую возможность. Это помогает нам понять, какие реакции более вероятны и какие могут сопровождаться выделением или поглощением тепла.
Какие факторы могут влиять на соответствие химической реакции закону Гесса?
В реальности могут быть некоторые факторы, которые могут привести к невыполнению закона Гесса. Например, изменение условий реакции, таких как давление или температура, может оказывать влияние на энергетическую эффективность реакции и, следовательно, на ее соответствие закону Гесса. Кроме того, некоторые реакции могут быть катализированы, что также может повлиять на изменение энергии реакции и на ее соответствие закону Гесса.
Какие последствия могут возникнуть, если химическая реакция не соответствует закону Гесса?
Если химическая реакция не соответствует закону Гесса, это может указывать на наличие дополнительных факторов, которые влияют на энергетическую эффективность реакции. Это может привести к трудностям в прогнозировании результатов реакции и понимании ее механизма. Также это может означать, что реакция может быть сложнее для производства или может требовать дополнительных условий, чтобы произойти.