Термодинамика – это раздел физики, изучающий законы и принципы, которым подчиняются тепловые явления. Среди этих законов особое место занимают законы термодинамики, определяющие взаимосвязь между энергией, теплом и работой. Основные положения термодинамики были сформулированы в начале XIX века и до сих пор не утратили своей актуальности.
Первый закон термодинамики устанавливает принцип сохранения энергии и гласит, что энергия не может создаваться и не может быть уничтожена, а только может переходить из одной формы в другую. Закон формулирует понятие внутренней энергии системы – суммы энергий всех молекул, из которых состоит вещество, и подчеркивает ее постоянство в замкнутой системе.
Второй закон термодинамики вводит понятие энтропии и устанавливает необратимость физических процессов. В соответствии с этим законом, энтропия замкнутой системы всегда стремится увеличиваться, то есть процессы направлены от упорядоченности к беспорядку. Важным следствием второго закона термодинамики является установление невозможности достижения абсолютного нуля температуры.
Термодинамика: определение и значение
Основное значение термодинамики заключается в том, что она позволяет описать и объяснить множество физических и химических явлений, которые происходят в природе. Термодинамические законы дают нам основные положения и принципы, которым подчиняются все физические и химические процессы.
Термодинамика изучает такие важные понятия, как тепло, работа, внутренняя и энтальпийная энергия, энтропия и температура. Она помогает ответить на такие вопросы, как «Как работает двигатель?», «Какие процессы происходят внутри звезды?», «Почему невозможно достичь абсолютного нуля?»
Термодинамика имеет огромное значение не только в физике и химии, но и в других областях науки и техники. Она применяется при проектировании и оптимизации энергетических систем, разработке новых материалов, исследовании процессов горения и плазмы, а также в области биологии и медицины.
Развитие термодинамики позволяет нам лучше понять и контролировать природные процессы, а также создавать новые технологии и улучшать существующие.
Основные принципы термодинамики
Основные принципы термодинамики включают:
- Первый закон термодинамики — принцип сохранения энергии. Согласно этому закону, энергия не может быть создана или уничтожена, только переходить из одной формы в другую. Также известен как принцип работы и теплоты.
- Второй закон термодинамики — принцип энтропии. Этот закон указывает на необратимость некоторых тепловых процессов и установление направления энергетических потоков. Согласно второму закону, энтропия изолированной системы имеет тенденцию увеличиваться с течением времени.
- Третий принцип термодинамики — принцип абсолютного нуля. Согласно этому принципу, при абсолютном нуле температуры (0 К) все молекулы системы находятся в своем основном состоянии, и энтропия системы достигает минимального значения.
Основные принципы термодинамики полностью определяют поведение тепла и энергии в физических системах и лежат в основе многих технических и технологических процессов. Их понимание необходимо для решения различных задач, связанных с энергетикой, теплообменом и процессами, происходящими в природе.
Первый закон термодинамики: сохранение энергии
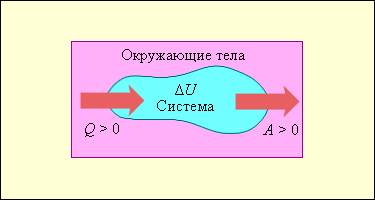
По сути, первый закон термодинамики является математическим выражением принципа сохранения энергии, который применим к преобразованиям энергии в системе. Он утверждает, что изменение внутренней энергии системы равно сумме теплового и работы, произведенной над системой:
ΔU = Q — W
где ΔU — изменение внутренней энергии системы, Q — добавленное тепло, и W — работа, произведенная системой или совершенная над системой.
Первый закон термодинамики имеет большое значение в науке и технологии, поскольку он является основой для понимания работы различных процессов и устройств, включая двигатели, теплообменники и холодильные системы. Соблюдение первого закона термодинамики позволяет оптимизировать эффективность этих процессов и устройств для более эффективного использования энергии.
Использование первого закона термодинамики также является важным инструментом для анализа состояния системы и вычисления работы и теплового потока в различных процессах, включая циклы Карно и тепловые двигатели. Это позволяет инженерам и ученым разрабатывать новые технологии и усовершенствовать существующие системы, чтобы достичь большей эффективности и экономии энергии.
Второй закон термодинамики: необратимость процессов
Это значит, что энтропия системы всегда увеличивается или остается постоянной, но никогда не уменьшается со временем. Энтропия — это мера хаоса или беспорядка в системе. Второй закон термодинамики позволяет нам объяснить, почему наблюдается естественное направление процессов в нашем мире.
Процессы, которые происходят самопроизвольно, в результате увеличения энтропии, называются необратимыми. В то время как обратимые процессы сохраняют энтропию системы постоянной. Различные формы энергии, такие как тепловая и механическая, могут превращаться одна в другую, но всегда происходит потеря энергии в виде тепла в окружающую среду.
Необратимость процессов, связанная с вторым законом термодинамики, имеет большое значение в различных областях науки и техники. Она объясняет, почему нельзя разработать устройство, которое будет работать без потерь энергии или создать постоянное движение без внешнего источника энергии.
Второй закон термодинамики и необратимость процессов стали основополагающими принципами в развитии технологий, таких как производство электроэнергии, двигатели внутреннего сгорания, холодильные установки и др. Понимание этих принципов помогает нам более эффективно использовать энергию и повышать устойчивость системы.
Второй закон термодинамики даёт нам больше информации о том, как работает вселенная и предоставляет ключевые принципы для различных научных и инженерных исследований. Он позволяет нам понять, как энергия перерабатывается и перемещается в системе, и, в конечном итоге, помогает нам лучше понять мир вокруг нас.
Третий закон термодинамики: невозможность достижения абсолютного нуля
Третий закон термодинамики устанавливает, что невозможно достичь абсолютного нуля температуры. Абсолютный ноль − это теоретическая граница, определенная как нулевая температура, при которой движение частиц прекращается полностью. В абсолютных единицах температуры это равно 0 К (кельвинов).
Согласно третьему закону термодинамики, представленному в 1912 году Вальтером Нернстом, приближение к абсолютному нулю требует бесконечного числа шагов, исходящих из некоторой исходной температуры. Такое приближение практически невозможно ввиду физических ограничений.
Сама идея абсолютного нуля возникла на основе наблюдений низких температур и второго начала термодинамики о невозможности преобразования всего тепла в работу. Абсолютный ноль является нижней границей, при которой энергия затрачивается минимально и движение частиц вещества полностью прекращается.
Однако третий закон термодинамики утверждает, что абсолютный ноль недостижим, даже при бесконечном числе шагов. Это объясняется тем, что при достижении очень низких температур, подходящих к абсолютному нулю, все материалы сталкиваются с такими явлениями, как квантовые флуктуации и нулевые колебания, которые не допускают полного затухания движения частиц.
Третий закон термодинамики имеет множество физических и практических применений. Этот закон используется при определении энтропии и характеристик кристаллов при очень низких температурах, а также при исследовании и моделировании различных процессов и явлений, связанных с состоянием вещества.
Основные положения термодинамики
Первый закон термодинамики, также известный как закон сохранения энергии, утверждает, что энергия не может быть создана или уничтожена, она может только преобразовываться из одной формы в другую. Это означает, что сумма энергии системы и ее окружающей среды не изменяется в процессе перехода из одного состояния в другое.
Второй закон термодинамики устанавливает, что процессы в природе протекают в определенном направлении и не могут происходить самопроизвольно в обратном направлении. Он описывает понятие энтропии, которая является мерой беспорядка или неупорядоченности системы. Второй закон термодинамики означает, что энтропия всегда увеличивается в изолированной системе.
Третий закон термодинамики говорит о том, что при абсолютном нуле температура вещества достигает минимального значения, а энтропия достигает нуля. Это лимитационное положение в термодинамике, не достижимое в реальной жизни.
Основные положения термодинамики являются основой для понимания тепловых процессов и эффективности систем, и имеют широкое применение в науке и технике.
Работа системы и ее внутренняя энергия
Работа системы может быть положительной или отрицательной в зависимости от направления передачи энергии. Например, при расширении газа в цилиндре происходит положительная работа, так как энергия передается от системы к внешней среде. В то же время, при сжатии газа работа будет отрицательной, так как энергия передается от внешней среды к системе.
Внутренняя энергия системы может изменяться в результате изменения ее теплового состояния или механической работы. Тепловое состояние системы определяется ее температурой, давлением и объемом. Изменение внутренней энергии системы определяется разницей между начальной и конечной состояниями системы.
Важно отметить, что закон сохранения энергии применяется к системе в целом, то есть он учитывает как работу системы, так и ее внутреннюю энергию. Соотношение между работой и изменением внутренней энергии системы описывается первым законом термодинамики.
Тепловой контакт и теплообмен
Теплообмен — это процесс передачи тепловой энергии между двумя телами, находящимися в тепловом контакте. Теплообмен может происходить различными способами:
- Проводимостью — передача тепла через материал или твердое вещество.
- Конвекцией — передача тепла через газы или жидкости, благодаря перемещению частиц с высокой температурой.
- Излучением — передача тепла электромагнитными волнами, не требующая среды для передачи.
Теплообмен — важный физический процесс, применимый в различных областях науки и техники, таких как теплотехника, теплообменные аппараты, энергетические системы и другие.
Энтропия и ее изменение
Изменение энтропии можно выразить через формулу ΔS = Sконечное — Sначальное. Положительное значение ΔS указывает на увеличение энтропии системы, а отрицательное значение — на ее уменьшение.
При переходе системы из упорядоченного состояния в более хаотичное, энтропия обычно увеличивается. Например, при нагревании вещества его молекулы начинают двигаться быстрее и менее упорядоченно, что приводит к увеличению энтропии.
Однако, есть исключения из этого правила. Например, при переходе вещества из жидкого состояния в твердое энтропия обычно уменьшается. В твердом состоянии молекулы упорядочены и движутся меньше, что приводит к уменьшению энтропии.
Закон сохранения энтропии утверждает, что в изолированной системе энтропия остается постоянной или увеличивается. Это означает, что процессы, в результате которых энтропия снижается, требуют добавления энергии из внешнего источника.
Изучение энтропии и ее изменение позволяет лучше понять природу тепловых процессов и использовать эту информацию для улучшения эффективности работы систем.
Вопрос-ответ:
Что такое закон термодинамики?
Закон термодинамики — это основные положения и принципы, описывающие взаимодействие тепла, работы и энергии в системах.
Сколько существует законов термодинамики?
Существует три основных закона термодинамики, каждый из которых формулирует определенные принципы и закономерности взаимодействия систем.
Какие принципы закона термодинамики могут быть применены в повседневной жизни?
В повседневной жизни применение находят такие принципы закона термодинамики, как сохранение энергии, эффективное использование тепла и работы, а также оптимизация термодинамических процессов для достижения нужных результатов.
Почему закон термодинамики является важным для физики и инженерных наук?
Закон термодинамики является важным для физики и инженерных наук, потому что он позволяет понять и предсказать поведение систем при различных термодинамических процессах, а также разработать эффективные системы, основанные на принципах термодинамики.